L'atmosfera terrestre contiene una concentrazione di anidride carbonica e di monossido di carbonio sempre crescente, generata dalla combusitone dei combustibili fossili, e di metano (CH4), proveneniente dalle risaie e dalle vacche.
Il gruppo più grande di tutti questi componenti è quello costituito da carbonio e idrogeno. Conosciamo come minimo circa 1 milione di composti organici e questo numero aumenta rapidamente ogni anno. Anche se la classificazione non è rigorosa, il carbonio forma un'ulteriore serie di composti classificati come inorganici, in numero molto più basso rispetto a quello dei composti organici.
Il carbonio elementare esiste in due forme cristalline allotropiche ben definite: diamante e grafite. Altre forme a bassa cristallinità sono il carbonio vegetale ed il fumo nero. Il carbonio chimicamente puro puo' essere preparato attraverso la decomposizione termica dello zucchero (saccarosio) in assenza di aria. Le proprietà fisiche e chimiche del carbonio dipendono dalla sua struttura cristallina.
La sua densità oscilla tra 2,25 g/cm³ per la grafite e 3,51 g/cm³ per il diamante. Il punto di fusione della grafite è 3500ºC (6332ºF) ed il punto di ebollizione estrapolato è 4830ºC (8726ºF). Il carbonio elementare è una sostanza inerte, insolubile in acqua, in acidi e basi diluiti, così come i solventi organici. Alle alte temperature si lega con ossigeno per formare monossido di carbonio o il anidride carbonica. Con agenti ossidanti caldi, come nitrato di potassio e acido nitrico, si ottiene acido metilico C6(CO2H)6. Fra gli alogeni soltanto il fluoro reagisce con il carbonio elementare. Un alto numero di metalli si unisce con l'elemento ad alte temperature per formare i carburi.
Forma tre componenti gassosi con l'ossigeno: ossido di carbonio, CO, anidride carbonica, CO2 e il subossido di carbonio, C2O2. I primi due sono i più importanti dal punto di vista industriale. Il carbonio forma composti con gli alogeni con formula generale CX4, dove la X indica fluoro, cloro, bromo o iodio. A temperatura ambiente il tetrafluoruro di carbonio è gassoso, il tetracloruro è liquido e gli altri due composti sono solidi. Sono inoltre noti i tetralidi misti di carbonio. Il più importante di tutti potrebbe essere il diclorodifluorometano, CCl2F2, detto freon.
Il carbonio nell'ambiente
Il carbonio ed i suoi composti sono ampiamente distribuiti in natura. Si stima che il carbonio formi lo 0.032% della crosta terrestre. Il carbonio libero si trova in grandi serbatoi in forma di antracite, forma amorfa dell'elemento con altri composti complessi carbonio-idrogeno-azoto. Il carbonio cristallino puro si trova in forma di grafite e diamante.
Grandi quantità di carbonio si trovano sotto forma di composti. Il carbonio è presente nell'atmosfera come anidride carbonica nello 0.03% in volume. Molti minerali, come calcare, dolomite, gesso e marmo, contengono carbonati. Tutte le piante vivienti e gli animali sono formati da composti organici complessi in cui il carbonio è unito con idrogeno, ossigeno, azoto ed altri elementi. Le piante e gli animali restanti formano i depositi: con petrolio, asfalto e bitume. I giacimenti di gas naturale contengono composti costituiti da carbonio e idrogeno.
Applicazioni
L'elemento libero ha molte applicazioni, inclusa decorazione con diamanti in gioiellerina o con il pigmento nero fumo per automobili ed inchiostro della stmapante. Un'altra forma del carbonio, la grafite, è usata per crogioli a temperatura, gli elettrodi delle pile a secco e ad arco di luce, punte di matite e come lubrificante. Il carbonio vegetala, una forma amorfa del carbonio, è usato come agente assorbente e sbiancante per gas.
Nessun elemento e' tanto importante per la vita quanto il carbonio, in quanto solo il carbonio forma singoli legami forti con se' stesso che sono abbastanza stabili da resistere all'attacco chimico in condizioni ambiente. Questo da' al carbonio la capacita' di fornire lunghe catene e anelli di atomi, che costituiscono la base strutturale di molti composti che includono le cellule viventi, il piu' importante dei quali e' il DNA.
I composti del carbonio hanno molti usi. L'anidride carbonica è usata nella carbonatazione delle bevande, negli estintori e, allo stato solido, come dispositivo di raffreddamento (ghiaccio asciutto). L'ossido di carbonio è usato come agente riduttore in molti processi metallurgici. Il carbonio tetracloruro ed il disolfuro di carbonio sono importanti solventi industriali. Freon è usato nei sistemi di raffreddamento. Il carburo di calcio è usato per preparare l'acetilene; è usato per taglio e saldatura dei metalli, così come per la preparazione di altri composti organici. Altri carburi metallici hanno usi importanti grazie alla loro resistenza al calore e come taglierine per metalli.
Effetti del carbonio sulla salute
Il carbonio elementare ha una tossicità molto bassa. I dati relativi ai rischi per la salute presentati qui si basano sulle esposizioni a carbonio nero, non a carbonio elementare. L'esposizione cronica tramite inalazione a carbonio nero può provocare danneggiamento provvisorio o permanente dei polmoni e del cuore.La pneumoconiosi è stata rilevata in operai impiagati nella produzione di carbonio nero. Condizioni della palle come infiammazioni dei follicoli dei capelli e lesioni mucose orali sono state inoltre riportate in seguito di esposizione cutanea.
La cancerogenicita' del nero di carbonio è stata elencata dall'agenzia internazionale per ricerca sul cancro (IARC) all'interno del gruppo 3 (l'agente non è classificabile relativamente alla sua carcinogenicità per gli esseri umani.)
Alcuni semplici composti del carbonio possono essere molto tossici, come il monossido di carbonio (CO) o il cianuro (CN-)
Il carbonio 14 è uno dei radionuclidi usati nelle prove atmosferiche delle armi nucleari, che sono iniziate nel 1945, con una prova degli Stati Uniti e finite nel 1980 con una prova in Cina. È fra i radionuclidi longevi che hanno prodotto e continueranno a provocare un aumento del rischio di cancro per decadi e secoli a venire. Esso può anche attraversare la placenta, legarsi organicamente alle cellule in sviluppo e mettere quindi in pericolo il feto.
La maggior parte di quello che mangiamo e' fatto da composti di carbonio, dando un'assunzionr giornaliera di carbonio di 300 g. La digestione consiste nella rottura di questi composti in molecole che possono essere assorbite dalle pareti di stomaco e intestino. Sono quindi trasportati dal sangue a siti in cui vengono ossidati per rilasciare l'energia che contengono. www.lenntech.it
Il monossido di carbonio, si crea dalle combustioni parziale di sostanze organiche, (come carbone, carta, benzina, nafta, gas, legno, ecc) quando vi è una bassa concentrazione di ossigeno
È un gas incolore, inodore ed insapore che si miscela molto bene con l’aria ( anche essendo più leggero di quest’ultima ) e può facilmente penetrare attraverso soffitti e pareti, caratteristiche sicuramente poco favorevoli per l’uomo in quanto il monossido di carbonio è anche tossico.
È uno dei fattori d’inquinamento atmosferico più diffuso in questo secolo.
il monossido di carbonio reagisce con soluzioni dei metalli alcalini in ammoniaca liquida, formando lo ione esotico ¯OCCO¯ (C2O22-) e questa sostanza è usata principalmente, prodotta da carbon coke e aria, alla base dell’altoforno, come riducente dei minerali ferrosi nella produzione dell’acciaio.
È un gas incolore, inodore ed insapore che si miscela molto bene con l’aria ( anche essendo più leggero di quest’ultima ) e può facilmente penetrare attraverso soffitti e pareti, caratteristiche sicuramente poco favorevoli per l’uomo in quanto il monossido di carbonio è anche tossico.
È uno dei fattori d’inquinamento atmosferico più diffuso in questo secolo.
il monossido di carbonio reagisce con soluzioni dei metalli alcalini in ammoniaca liquida, formando lo ione esotico ¯OCCO¯ (C2O22-) e questa sostanza è usata principalmente, prodotta da carbon coke e aria, alla base dell’altoforno, come riducente dei minerali ferrosi nella produzione dell’acciaio.
Tossicità e danni
Vi sono molti casi che riguardano l’intossicazione da monossido di carbonio, alcuni dei quali sono finiti in tragedia causando alle vittime di questo subdolo gas la morte per asfissia (o la così detta “morte rosa”).
Esistono vari livelli di intossicazione che vengono classificati in base alla percentuale di CO presente nel sangue
Essi sono:
Vi sono molti casi che riguardano l’intossicazione da monossido di carbonio, alcuni dei quali sono finiti in tragedia causando alle vittime di questo subdolo gas la morte per asfissia (o la così detta “morte rosa”).
Esistono vari livelli di intossicazione che vengono classificati in base alla percentuale di CO presente nel sangue
Essi sono:
- intossicazione lieve: per un’intossicazione di questo livello la percentuale del CO presente nel sangue è dallo 0% al 20%. A queste percentuali si possono avvertire i primi sintomi tra i quali nausea vomito e mal di testa, che vengono scambiati molte volte per malesseri dovuti ad altri fattori invece che per inspirazione di monossido di carbonio. A questo livello si è ancora fuori pericolo
- intossicazione media : la percentuale di CO nel sangue deve essere compresa almeno tra il 20%-60%, in questa fascia si cominciano ad avvertire problemi molto più rilevanti e non paragonabili a semplici disfunzioni, tipo problemi agli occhi come visibilità offuscata, debolezza e battiti accelerati .
- intossicazione grave: se la percentuale di CO nel sangue è superiore al 60% . questa è la fascia di intossicazione più pericolosa in quanto i sintomi che si manifestano sono più forti ed evidenti come ipertensione, dolori al petto e disorientamento e in casi più gravi si rischia addirittura il coma.
le varie intossicazioni presentavo diversi sintomi l’una dall’altra ecco un elenco dettagliato.
Classe di gravità
|
Sintomi e segni
|
Lieve
|
cefalea, nausea, vomito, astenia
|
Media
|
confusione mentale, lentezza di ideazione, visione offuscata, debolezza, atassia, anomalie comportamentali, dispnea da sforzo, tachicardia.
|
Grave
|
disorientamento, sopore, convulsioni, alterazioni alla TAC dell'encefalo, ipotensione, dolore toracico, aritmie, edema polmonare, acidosi lattica, sincope, coma
|
La sua elevata tossicità per gli esseri viventi è dovuta alla sua forte affinità con l’emoglobina .
L’emoglobina è la componente principale dei globuli rossi, è formata da circa 10000 atomi di idrogeno, carbonio, ossigeno e in più quattro atomi di ferro, che sono il suo elemento più importante, in quanto questi ultimi stanno al centro di un gruppo di atomi che formano il pigmento chiamato eme ed è grazie a questa componete che i globuli rossi sono capaci di legarsi e trasportare l’ossigeno a tutti gli organismi nel corpo.
In presenza del monossido di carbonio comunque le cose cambiano, infatti l’affinità che l’emoglobina ha con questa sostanza è 200 volte più alta di quella che possiede con l’ossigeno e forma così la carbossiemoglobina(HbCO).
La conseguenza della presenza di questa sostanza è la saturazione dell’emoglobina che non può più legarsi con l’ossigeno formando così la ossiemoglobina(HbO2) e di conseguenza L’O2 non può più essere trasportato agli organi del corpo causando, in questo modo, gravi danni agli organi in particolare al cervello e al cuore ( dato che hanno bisogno di molto ossigeno per poter svolgere il loro compito) la perdita dei sensi e di seguito la morte.
L’emoglobina è la componente principale dei globuli rossi, è formata da circa 10000 atomi di idrogeno, carbonio, ossigeno e in più quattro atomi di ferro, che sono il suo elemento più importante, in quanto questi ultimi stanno al centro di un gruppo di atomi che formano il pigmento chiamato eme ed è grazie a questa componete che i globuli rossi sono capaci di legarsi e trasportare l’ossigeno a tutti gli organismi nel corpo.
In presenza del monossido di carbonio comunque le cose cambiano, infatti l’affinità che l’emoglobina ha con questa sostanza è 200 volte più alta di quella che possiede con l’ossigeno e forma così la carbossiemoglobina(HbCO).
La conseguenza della presenza di questa sostanza è la saturazione dell’emoglobina che non può più legarsi con l’ossigeno formando così la ossiemoglobina(HbO2) e di conseguenza L’O2 non può più essere trasportato agli organi del corpo causando, in questo modo, gravi danni agli organi in particolare al cervello e al cuore ( dato che hanno bisogno di molto ossigeno per poter svolgere il loro compito) la perdita dei sensi e di seguito la morte.
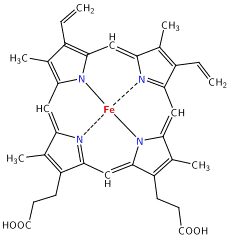 Molecola dell’emoglobina: Formula eme:
Molecola dell’emoglobina: Formula eme:

Fonti della produzione di monossido di carbonio
Il monossido di carbonio può essere prodotto tramite diverse fonti tra le quali ci sono molti strumenti che sono presenti nelle case tipo, i fornelli, le stufe, gli impianti di riscaldamento a gas quando queste apparecchiature sono difettose,dai camini quando non si trovano in locali ben ventilati . queste apparecchiature ad ogni modo si utilizzano specialmente in inverno e il livello di monossido di carbonio non dovrebbe essere molto alto, invece no, perché questo gas letale viene prodotto anche da cose di utilizzo quotidiano quali l’automobile e le sigarette.
Principalmente per quest’ultime due fonti la popolazione urbana è decisamente esposta a dosi di monossido di carbonio ogni giorno, principalmente se si trova in grandi città.questa lenta intossicazione prende il nome di ossicarbonismo e si manifesta con sintomi nervosi e respiratori.
È stata scoperta dal team di ricerche della clinica mayo la presenza di monossido di carbonio nell’apparato digerente che funge da regolatore dei muscoli lisci del tratto gastrointestinale.
Il cibo, grazie alle contrazioni del monossido di carbonio prodotto di continuo da cellule poste sulle pareti intestinali, si sposta nell’apparato digerente.
Ogni variazione della quantità del monossido di carbonio in quest’apparato ne determina il suo buon funzionamento, fortunatamente la produzione di CO viene bilanciata da un gradiente, spesso alcuni millimetri che riesce a ricalcare in questo modo l’usuale fisiologia dell’apparato tramite questo micidiale gas.
Il monossido di carbonio può essere prodotto tramite diverse fonti tra le quali ci sono molti strumenti che sono presenti nelle case tipo, i fornelli, le stufe, gli impianti di riscaldamento a gas quando queste apparecchiature sono difettose,dai camini quando non si trovano in locali ben ventilati . queste apparecchiature ad ogni modo si utilizzano specialmente in inverno e il livello di monossido di carbonio non dovrebbe essere molto alto, invece no, perché questo gas letale viene prodotto anche da cose di utilizzo quotidiano quali l’automobile e le sigarette.
Principalmente per quest’ultime due fonti la popolazione urbana è decisamente esposta a dosi di monossido di carbonio ogni giorno, principalmente se si trova in grandi città.questa lenta intossicazione prende il nome di ossicarbonismo e si manifesta con sintomi nervosi e respiratori.
È stata scoperta dal team di ricerche della clinica mayo la presenza di monossido di carbonio nell’apparato digerente che funge da regolatore dei muscoli lisci del tratto gastrointestinale.
Il cibo, grazie alle contrazioni del monossido di carbonio prodotto di continuo da cellule poste sulle pareti intestinali, si sposta nell’apparato digerente.
Ogni variazione della quantità del monossido di carbonio in quest’apparato ne determina il suo buon funzionamento, fortunatamente la produzione di CO viene bilanciata da un gradiente, spesso alcuni millimetri che riesce a ricalcare in questo modo l’usuale fisiologia dell’apparato tramite questo micidiale gas.
Come proteggersi ?
Per proteggersi dalle varie intossicazioni da CO, vi sono delle precauzioni che sarebbe meglio tenere a mente.
Esse sono:
Per proteggersi dalle varie intossicazioni da CO, vi sono delle precauzioni che sarebbe meglio tenere a mente.
Esse sono:
- ventilare con aperture dirette sull’esterno, tutti i locali dove sono in funzione degli apparecchi per il riscaldamento a fiamma libera.
- installare dei rivelatori di CO nella propria abitazione da un personale tecnico esperto facendoci rilasciare le certificazioni di conformità alle norme di sicurezza e fargli eseguire controlli periodici (si consiglia di non eseguire installazioni fai da te).questi strumenti sono a basso costo, rivelano la presenza di CO anche a delle basse concentrazioni
- se è presente un camino nell’abitazione far controllare da un tecnico specializzato l’efficienza della canna fumaria, specialmente nel periodo che precede l’inizio dell’inverno
- se si è un fumatore non fumare nei locali di soggiorno prolungato e in particolare nelle camere da letto.( non fumare se si è in cinta, in quanto il monossido di carbonio potrebbe danneggiare il feto)
- evitare ( se è possibile ) soste prolungate in ambienti con traffico automobilistico elevato
Nicheltetracarbonile
Esiste una sostanza che si può ottenere dalla sintesi diretta del monossido di carbonio con il nichel metallico ovvero il nicheltetracarbonile , detto anche tetracarbonilnichel (Ni(CO)4 ).
Questo complesso organometallico ( ovvero che contiene un legame metallo-carbonio) fu scoperto da Ludwig Mong nel 1890.
Ottenere questa sostanza è piuttosto semplice in quanto il nichel metallico reagisce direttamente con il monossido di carbonio a temperatura ambiente .
La sua struttura è formata da una molecola di nichel al centro legata a 4 molecole di CO.
Questo complesso organometallico ( ovvero che contiene un legame metallo-carbonio) fu scoperto da Ludwig Mong nel 1890.
Ottenere questa sostanza è piuttosto semplice in quanto il nichel metallico reagisce direttamente con il monossido di carbonio a temperatura ambiente .
La sua struttura è formata da una molecola di nichel al centro legata a 4 molecole di CO.
Il nicheltetracarbonile si presenta come un liquido incolore ma al contrario del suo aspetto “semplice” viene ignorata la sua grande pericolosità, infatti è una sostanza altamente infiammabile , esplosiva e soprattutto estremamente tossica.
La principale causa dell’avvelenamento da nicheltetracarbonile è dovuta alla sua inalazione in quanto è estremamente volatile, ma pur essendo il caso più frequente quello appena descritto non è l’unico modo per rischiare un’ avvelenamento, infatti si può essere intossicati da questa sostanza anche dal semplice contatto con la pelle.
Vi sono due stadi dell’intossicazione da nicheltetracarbonile :
La principale causa dell’avvelenamento da nicheltetracarbonile è dovuta alla sua inalazione in quanto è estremamente volatile, ma pur essendo il caso più frequente quello appena descritto non è l’unico modo per rischiare un’ avvelenamento, infatti si può essere intossicati da questa sostanza anche dal semplice contatto con la pelle.
Vi sono due stadi dell’intossicazione da nicheltetracarbonile :
- stadio 1: è la fase più breve e dura poche ore, durente le quali si hanno forti mal di testa e dolori intensi al torace
- stadio 2: questa fase ha inizio dopo 16 ore circa . qui ha inizio una polmonite chimica che presenta tre sintomi ben precisi: tosse, mancanza di respiro ed estrema fatica.
Il periodo di convalescenza è estremamente lungo e faticoso in quanto si manifestano sintomi come depressione, mancanza di forze ( astenia) e mancanza di respiro durante gli sforzi (dispnea da sforzo) anche se ad ogni modo questi danni non sono permanenti.
Se non vi si accorge di questa intossicazione entro 4 giorni può sopraggiungere la morte per insufficienza cardiorespiratoria o renale
Se non vi si accorge di questa intossicazione entro 4 giorni può sopraggiungere la morte per insufficienza cardiorespiratoria o renale
Utilizzi monossido di carbonio.
Il monossido di carbonio, al contrario di quanto si pensa, non è solo una sostanza pericolosa, ma può anche rivelarsi un ottimo combustibile in quanto, quando viene bruciato, rilascia una buona quantità di calore, infatti la sua entalpia standard di formazione è di
ΔH° (gas) = -565.53 kJ/mol.
Per fruttare i vantaggi di questa sostanza di solito si mescola con altre sostanze dando vita a nuovi gas. Tre tra i prodotti più conosciuti sono il gas d’aria, il gas da carbone e il più importante dei tre in gas d’acqua
ΔH° (gas) = -565.53 kJ/mol.
Per fruttare i vantaggi di questa sostanza di solito si mescola con altre sostanze dando vita a nuovi gas. Tre tra i prodotti più conosciuti sono il gas d’aria, il gas da carbone e il più importante dei tre in gas d’acqua
Gas d’acqua
Il gas d’acqua, detto anche “gas blu” per via della sua fiamma durante la combustione di colore blu, è una miscela gassosa composta dal monossido di carbonio e dall’idrogeno e viene prodotto facendo passare su uno strato di coke incandescente ( 1400°C) del vapore d’acqua dando luogo alla reazione:
H2O + C = CO + H2
Il gas d’acqua viene utilizzato tale e quale per molti e vari scopi, ma si può utilizzare anche miscelato con altri gas quali il gas d’aria (diventando così un carburante alternativo nelle auto a gasogeno) oppure per usi cittadini con il gas d’olio.
L’impianto per la sua produzione occupa poco spazio e si può mettere in funzione quando lo si desidera . di solito se l’impianto produce gas per usi cittadini rimane in attivo per tutto il periodo estivo in quanto l’utilizzo del gas è minore, quando viene rimesso in funzione nelle stagioni invernali non servono accorgimenti particolari al di fuori dei controlli di routine in quanto anche se disattivato si mantiene in ottime condizioni
L’impianto per la sua produzione occupa poco spazio e si può mettere in funzione quando lo si desidera . di solito se l’impianto produce gas per usi cittadini rimane in attivo per tutto il periodo estivo in quanto l’utilizzo del gas è minore, quando viene rimesso in funzione nelle stagioni invernali non servono accorgimenti particolari al di fuori dei controlli di routine in quanto anche se disattivato si mantiene in ottime condizioni
Apparecchiatura :
l’impianto per la produzione di gas d’acqua è composto da :
l’impianto per la produzione di gas d’acqua è composto da :
- 3 recipienti
- generatore ( 3m di diametro, 4,5 m di altezza)
- Carburatore : al suo interno sono predisposti a scacchiera dei mattoni surriscaldati
- Surriscaldatore : al suo interno sono predisposti a scacchiera dei mattoni refrigeranti
Tutti questi materiali sono di forma cilindrica simili nella grandezza e tutti dello stesso materiale ovvero il ferro.
Produzione:
Per poterlo ottenere si devono effettuare diverse fasi:
- il coke si carica nel generatore tramite un’apertura dall’alto e vi viene portato all’incandescenza. in questo apparecchio vi sono quattro fasi importanti (tutte con un proprio tempo di durata) per poter mantenere il coke all’incandescenza il più allungo possibile.
- immissione di vapore (fase discendente e fase ascendente): ( 1 ½ minuto): una metà del vapor d’acqua utilizzato viene immesso dall’alto del generatore e i gas che si formano escono dal basso mentre l’altra meta viene immesso dal basso del generatore, i gas che si formano escono dal basso
- riposo ( 1 minuto): dopo che il vapore è stato immesso nel generatore quest’ultimo viene fatto riposare
- rivivificazione (2 minuti): in questa fa se viene immessa dell’aria
queste operazioni sono essenziali, perché essendo tutto il processo una reazione endotermica (e il calore perso per colpa di questa caratteristica si aggiunge a quello perso per irradiazione ), la temperatura del gas diminuisce e se giunge sotto i 1000°C, il vapore e il coke reagiscono in modo diverso e danno vita alle seguente reazione:
2H2O+C à CO+2H2
Il monossido di carbonio viene così rimpiazzato dall’anidride carbonica che risulta come un prodotto indesiderato in questo tipo di processo, in quanto non è combustibile
- i gas formati da questo processo del generatore si riuniscono in un tubo largo 1 metro che conduce al carburatore ed entrano in questo modo tutti nello stesso punto . nel carburatore, durante il periodo di rivivficazione del generatore, la temperatura sale scaldando i mattoni al suo interno. Il gas entrato dall’alto in questo processo viene mischiato con l’olio atomizzato che viene spruzzato dall’alto, sino a che questa nebbia di olio viene trasportata dal gas sino alla scacchiera, dove la maggior parte di essa viene vaporizzata formando anche una certa quantità di catrame.
- i gas che si trovano nel carburatore escono dal basso ed passando per un tubo entrano nel surriscaldatore il quale grazie ai mattoni refrigeranti con il quale è riempito effettua il craking dell’olio e l’intimo miscuglio del gas .
- subito dopo effettuato il craking il gas viene inviato a degli apparecchi di purificazione, che per lo più sono casse di purificazione di calce e di ossido di ferro, per poi essere messi nei serbatoi e pronti per la distribuzione larapedia
Nessun commento:
Posta un commento